Il microbioma: i nostri batteri, la nostra salute
L'insieme di microorganismi che ci abita ci protegge da numerose malattie. Adesso è possibile conoscerli e preservarli.
Infezioni · 26 agosto, 2015
Enrico Tagliaferri
Azienda ospedaliero-universitaria pisana
Giorgio Tulli
Gruppo di lavoro Regionale per la lotta alla Sepsi
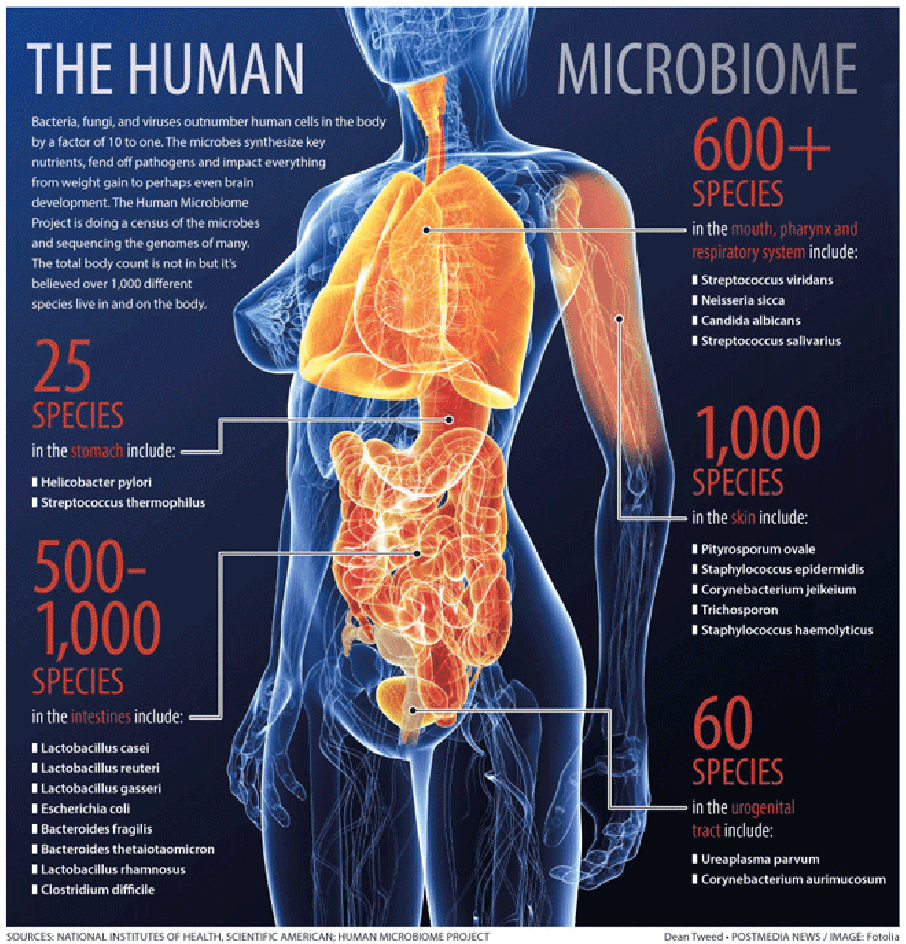
Il microbioma è l'insieme di batteri, protozoi, virus e funghi che vive nel corpo dell'uomo: sulla pelle, nelle vie respiratorie, urinarie, nel tratto urogenitale, ma soprattutto nell'apparato digerente (Figura 1).
Figura 1 - Distribuzione e varietà del micro bioma umano (Human Microbiome Project, National Institutes of Health, 2015)
Grazie alle moderne tecnologie di microbiologia e biologia molecolare, recentemente è stato possibile definire con maggior precisione quantità e qualità dei microorganismi che ci abitano. In passato potevamo contare soltanto sulle metodiche colturali, non abbastanza sensibili ed estremamente laboriose per un campione ricco di diverse specie come le feci. Da alcuni anni abbiamo invece a disposizione diverse metodiche di amplificazione genica, che ricercano RNA e DNA dei batteri, più semplici e affidabili e meno costose rispetto alle procedure di prima generazione. In questo senso ricordiamo il lavoro dello Human Microbiome Project, dell'americano National Institutes of Health, che dal 2008 ha isolato più di 1.300 specie da più siti corporei di 300 individui, creato un database del patrimonio genetico del microbioma e un portale on line a disposizione della comunità scientifica.
Nel nostro intestino vivono normalmente molti più batteri delle nostre stesse cellule, di numerose specie, interconnesse in un complesso sistema di relazioni. È noto da tempo che la flora intestinale svolge funzioni importanti, ad esempio nella produzione di vitamine necessarie al nostro metabolismo. Più recentemente però sta emergendo una relazione molto più stretta di quanto non ritenuto sinora tra microbioma e stato di salute. Dalla nascita alla morte il nostro microbioma si forma e si modifica in relazione alla nostra alimentazione, le nostre abitudini, il nostro ambiente di vita e di lavoro, le malattie che ci colpiscono e le cure che assumiamo, e in tutto questo il microbioma ha un ruolo attivo, dinamico. Si ritiene infatti che il microbioma sia in grado di contribuire alla digestione dei cibi e all'assorbimento di nutrienti essenziali, ma anche di permettere la maturazione della mucosa intestinale, di facilitare il sistema immunitario nel riconoscere e neutralizzare potenziali minacce, contrastare la colonizzazione da parte di agenti infettivi patogeni.
Alcuni autori addirittura hanno ipotizzato un ruolo del microbioma nella prosecuzione della specie: un microbioma più "sano" e protettivo in età giovanile e un microbioma indifferente o "nocivo" in età avanzata come meccanismo naturale finalizzato a favorire gli individui in età fertile1. Studi animali hanno rilevato una relazione tra microbioma, espressione di neurorecettori e livelli di neurotrasmettitori nel cervello e comportamento2. È stata ipotizzata una relazione tra microbioma e una lunga serie di patologie: malattie infiammatorie intestinali croniche come morbo di Crohn e colite ulcerosa3, steatosi epatica, obesità e diabete di tipo 24, artrite reumatoide5, cancro dello stomaco6, autismo7, depressione8 (Figura 2).

In ospedale e nelle strutture per lungodegenti sono ormai diffusi batteri e funghi resistenti agli antibiotici. I pazienti che assumono antibiotici e che hanno quindi una grave alterazione del microbioma, sono particolarmente a rischio di essere colonizzati e di sviluppare gravi infezioni, spesso mortali. Un caso paradigmatico è quello del Clostridium difficile, che in questi pazienti può causare una grave colite.
Purtroppo l'utilizzo degli antibiotici è spesso inappropriato. La maggior quantità di antibiotici viene consumata negli allevamenti animali allo scopo di aumentare la produzione anche se molti paesi hanno cercato di limitarne l'uso in questo settore. Troppo spesso però anche in ambito medico gli antibiotici vengono prescritti senza una reale indicazione, come nel caso della sindrome influenzale durante l'inverno. In ambito ospedaliero, vengono troppo spesso prescritti antibiotici ad ampio spettro, empiricamente, magari tralasciando di effettuare i prelievi per coltura oppure di ridurre lo spettro della terapia una volta identificato l'agente infettivo responsabile dell'infezione. In Italia, in particolare, utilizziamo in ospedale più antibiotici in generale e ad ampio spettro in particolare, rispetto alla maggior parte degli altri paesi europei, con il risultato che abbiamo tassi di resistenza molto più elevati9.
Da tutte queste considerazioni ne consegue che il ripristino di una flora intestinale normale potrebbe prevenire, curare o mitigare molte patologie. Purtroppo i probiotici, cioè miscele di batteri e funghi liofilizzati, attualmente in commercio, non si sono dimostrati efficaci nel prevenire la diarrea da antibiotici né la diarrea da C. difficile10. Il loro utilizzo nella pratica clinica non pare quindi giustificato. Tuttavia, esprimenti animali hanno dimostrato che è possibile determinare con le attuali tecnologie la composizione qualitativa e quantitativa dei microrganismi delle feci di individui sani e affetti da colite da C. difficile e curare l'infezione ripristinando il corretto microbioma11. Nell'uomo, il trapianto di feci si è dimostrato estremamente efficace nel curare l'infezione da C. difficile12. Altri dati ne suggeriscono l'efficacia anche nelle malattie infiammatorie intestinali croniche, la sindrome del colon irritabile e la sindrome metabolica13. Questa è certamente una procedura difficilmente applicabile su larga scala, ma la sua efficacia è un incentivo a proseguire su questo filone di ricerca.
Incoraggianti sono gli studi su un costituente del microbioma intestinale, l'Akkermansia muciniphila. Esperimenti animali suggeriscono che riportare alla normalità i livelli di A. muciniphila nell'intestino può ripristinare l'integrità della mucosa intestinale, attenuare gli effetti di una dieta ricca di grassi sul peso e sul metabolismo14.
Si tratta di una sfida difficile poiché la maggior parte degli studi concorda sul fatto che un microbioma "sano" è un microbioma vario, complesso, mentre un microbioma "malato" è ridotto ad un minor numero di specie. Si può quindi ipotizzare che un probiotico universale, adatto soprattutto alla prevenzione, sarà più probabilmente un insieme di batteri nella giusta proporzione, piuttosto che un sola specie, mentre in casi di patologie specifiche si potranno utilizzare probiotici più mirati, personalizzati.
In conclusione, il microbioma è un mondo vasto e complesso, ma le tecnologie che abbiamo adesso a disposizione ci aprono la possibilità di studiarlo, interpretarlo e correggerlo per contrastare molte patologie importanti. Una volta individuata la composizione dei probiotici i prezzi verranno condizionati dai costi delle procedure di coltura e confezionamento, che non dovrebbero essere proibitivi, e dai diritti di brevetto. Purtroppo gli investimenti delle case farmaceutiche sono generalmente rivolti a terapie di lunga durata che permettono un maggior ritorno economico, come gli antiblastici e i cosiddetti farmaci biologici. Sta alla politica introdurre incentivi per l'industria, come è stato fatto negli USA per gli antibiotici, e mantenere in vita la ricerca indipendente.
Bibliografia
- Blaser MJ, Webb GF. Host Demise as a Beneficial Function of Indigenous Microbiota in Human Hosts. MBio. 2014 Dec 16;5(6). pii: e02262-14. doi: 10.1128/mBio.02262-14.
- Cryan, J.F. & T.G. Dinan. 2012. Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour. Nat. Rev. Neurosci. 13: 701–712.
- Dalal SR, Chang EB. The microbial basis of inflammatory bowel diseases. J Clin Invest. 2014;124(10):4190–4196.
- Petschow B, Doré J, Hibberd P, Dinan T, Reid G, Blaser M, Cani PD, Degnan FH, Foster J, Gibson G, Hutton J, Klaenhammer TR, Ley R, Nieuwdorp M, Pot B, Relman D, Serazin A, Sanders ME. Probiotics, prebiotics, and the host microbiome: the science of translation. Ann N Y Acad Sci. 2013 Dec;1306:1-17. doi: 10.1111/nyas.12303. Epub 2013 Nov 22. Review.
- Scher JU, Bretz WA, Abramson SB. Periodontal disease and subgingival microbiota as contributors for rheumatoid arthritis pathogenesis: modifiable risk factors? Curr Opin Rheumatol. 2014 Jul;26(4):424-9. doi: 10.1097/BOR.0000000000000076.
- Nardone G, Compare D. The human gastric microbiota: Is it time to rethink the pathogenesis of stomach diseases? United European Gastroenterol J. 2015 Jun;3(3):255-60. doi: 10.1177/2050640614566846.
- Toh MC, Allen-Vercoe E. The human gut microbiota with reference to autism spectrum disorder: considering the whole as more than a sum of its parts. Microb Ecol Health Dis. 2015 Jan 28;26:26309. doi: 10.3402/mehd.v26.26309. eCollection 2015.
- Jiang H, Ling Z, Zhang Y, Mao H, Ma Z, Yin Y, Wang W, Tang W, Tan Z, Shi J, Li L, Ruan B. Altered fecal microbiota composition in patients with major depressive disorder. Brain Behav Immun. 2015 Aug;48:186-94. doi: 10.1016/j.bbi.2015.03.016. Epub 2015 Apr 13.
- ECDC Surveillance Report. Point prevalence survey of health care associated infections and antimicrobial use in European acute care hospitals 2011-2012. www.ecdc.europa.eu.
- Allen SJ et al . Lactobacilli and bifidobacteria in the prevention of antibiotic-associated diarrhoea and C. difficile diarrhoea in older inpatients (PLACIDE): a randomised, double-blind, placebo-controlled, multicentre trial. Lancet. 2013 Oct 12;382(9900):1249-57. doi: 10.1016/S0140-6736(13)61218-0. Epub 2013 Aug 8.
- Lawley TD et al. Targeted restoration of the intestinal microbiota with a simple, defined bacteriotherapy resolves relapsing Clostridium difficile disease in mice. PLoS Pathog. 2012;8(10):e1002995. doi: 10.1371/journal.ppat.1002995. Epub 2012 Oct 25.
- Ough E et al. Systematic Review of Intestinal Microbiota Transplantation (Fecal Bacteriotherapy) for Recurrent Clostridium difficile Infection. Clinical Infectious Diseases 2011;53(10):994–1002.
- Singh R, Nieuwdorp M, ten Berge IJ, Bemelman FJ, Geerlings SE. The potential beneficial role of faecal microbiota transplantation in diseases other than Clostridium difficile infection. Clin Microbiol Infect. 2014 Nov;20(11):1119-25. doi: 10.1111/1469-0691.12799. Epub 2014 Nov 7. Review.
- Everard, A., C. Belzer, L. Geurts, et al. 2013. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. Proc. Natl. Acad. Sci. U.S.A. 110: 9066–9071.

