Lezioni da ricordare dai seminari sull’antibiotico-resistenza 2020: una visione sistemica
Highlight dai nostri webinar
Antibiotico Resistenza · 15 luglio, 2020
Gemmi F
Coordinatore Osservatorio per la qualità e l'equità, ARS Toscana
I fenomeni biologici sono, per loro caratteristica, complessi. Un approccio riduzionista, basato sull’applicazione della metodologia causa - effetto, è destinato a successi transitori e fallimento nel medio e lungo periodo, e le recenti modalità di diffusione dell’antibiotico-resistenza registrate in Toscana convalidano questa osservazione.
Nei sistemi complessi le proprietà emergono dalle relazioni e le previsioni sono soggette a incertezza. Uno dei concetti cardine della teoria dei sistemi complessi è il principio dell’auto-organizzazione, definito come risultato di un processo dinamico di emergenza dal basso, basato sull’interazione locale tra le parti e privo di controllo centralizzato, attraverso cui un sistema complesso riorganizza le sue parti, per formare una nuova configurazione dotata di proprietà diverse rispetto alle componenti iniziali: proprietà emergenti. (De Toni, 2011)[1] Ci troviamo evidentemente nella zona di comfort delle specie batteriche.
In questo articolo saranno ripresi i contributi di Gianni Tamino, Alex Friedrich e Paolo Bonanni. La visione sistemica che intendiamo fornire comprende l’ecologia dei microrganismi, le caratteristiche organizzative e dinamiche dei sistemi sanitari e il ruolo strategico che le vaccinazioni possono assumere per il contrasto all’antimicrobico - resistenza.
Come ha descritto il professor Gianni Tamino, nella sua relazione intitolata “Uno sguardo d’insieme” devono essere considerati aspetti come l’ecologia microbica, il trasferimento i geni a livello batterico e l’evoluzione dei microbi e dei loro ambienti.
Per i microrganismi che colonizzano il nostro intestino e la nostra cute, noi rappresentiamo, né più né meno, una nicchia ecologica. Una nicchia ecologica lasciata libera da una specie viene inevitabilmente occupata da un’altra specie. Questa affermazione spiega molto del meccanismo di selezione delle specie batteriche resistenti agli antibiotici, potrebbe anche render conto di un fenomeno osservato nel 2019 e descritto nel Documento ARS 107 “L’antibiotico-resistenza e l’uso degli antibiotici in Toscana”: perché proprio nell’area Nord-ovest della Toscana, dove si era precedentemente registrata una importante riduzione della resistenza ai carbapenemi nelle enterobatteriacee, si è sviluppato un importante outbreak di enterobatteri NDM? Il controllo dell’uso degli antibiotici determina una riduzione della pressione selettiva, ma contano anche l’attuazione delle pratiche di infection control, il livello di invasività delle cure e le caratteristiche dei pazienti e dell'ambiente dove vivono. Se l’azione non è intrapresa su tutti questi livelli (forse con ulteriori elementi non ancora presi in considerazione) i successi rischiano di dimostrarsi effimeri.
Dal punto di vista delle capacità evolutive dei batteri, è importante considerare che
- le specie batteriche presenti sulla terra sono stimate in mille miliardi, di queste ne conosciamo lo 0,001% (Locey, 2016)[2], e che la loro biomassa è almeno 5 volte quella degli esseri umani;
- i batteri si scambiano correntemente materiale genetico con diversi meccanismi (figura 1);
- il ritmo evolutivo microbico è circa mezzo milione di volte più rapido di quello umano;
- l’evoluzione e la diversità di geni di resistenza agli antibiotici suggeriscono che quest abbiano una lunga storia evolutiva iniziata molto prima dell’era antibiotica.
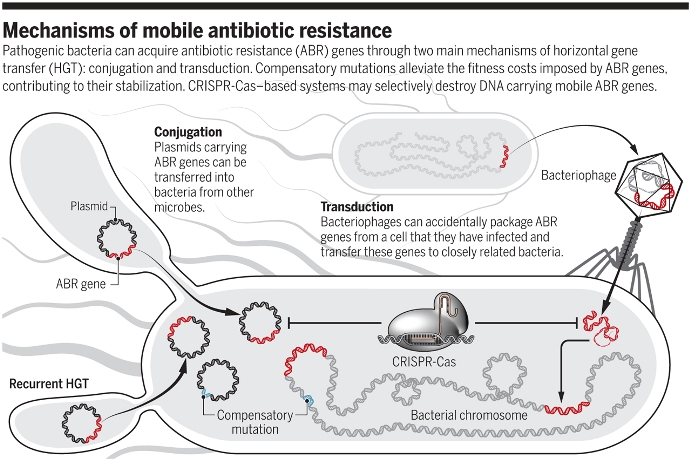
Figura 1 - Meccanismi di trasferimento dell’antibiotico resistenza (MacLean, 2019)[3]
Tutte queste forme di vita hanno sempre dovuto elaborare meccanismi di risposta alle minacce ambientali, tra cui quelle chimiche e quelle fisiche, ai fini di garantire la prosecuzione della specie. Contaminanti tossici per i batteri sono normalmente presenti nell’ambiente (antibiotici, metalli pesanti, nanomateriali) e sostanze antibatteriche sono prodotte da miceti e altri microrganismi che si trovano a competere tra di loro per i nutrienti.
L’utilizzo di antibiotici, come altri fattori di contrasto a organismi viventi (per esempio i pesticidi) determina la scomparsa di una buona parte degli organismi bersaglio, ma, in virtù della biodiversità delle popolazioni naturali, è molto probabile che qualche individuo risulti resistente: maggiore è l’uso di antibiotici, maggiore sarà la quantità di batteri divenuti resistenti che si riprodurranno nel tempo.
Dunque, i batteri hanno ottime qualità per poter continuare a proliferare a dispetto delle nostre decisioni terapeutiche e del nostro pressappochismo nell’attuare decise contromisure di controllo delle infezioni.
In cosa consiste la nostra percezione del problema dell’antibiotico resistenza? Il professor Alex Friedrich, dell’università di Groningen (Paesi Bassi) nella sua lettura magistrale “Control of hospital acquired infections and antimicrobial resistance in Europe: the way to go” descrive un modo di pensare comune in materia di antibiotico-resistenza, spiegando come questo si riveli insufficiente, pur basandosi su elementi teorici corretti:
- si usano troppi antibiotici
- si trascura l’igiene delle mani
- abbiamo buone linee guida, che non vengono applicate dagli operatori.
Viene evidenziato che la prescrizione di antibiotici in Italia raggiunge livelli tra i maggiori in Europa e tra i Paesi OCSE: nel Rapporto Health at a Glance 2019, OECD stima che il consumo degli antibiotici per le cure primarie in Italia superi del 50% la media dei Paesi OCSE: 28,3 DDD per 1.000 abitanti/die, rispetto a un valore medio di 17,85.
Tuttavia il fatto non deve sorprendere perché anche la spesa totale per farmaci è tra le più alte, indipendentemente dalla classe. Infezioni Obiettivo Zero aveva già pubblicato un articolo sui “Fattori sociali e culturali nell’uso degli antibiotici” (Gemmi, 2019)[4] evidenziando che le importanti differenze nell’uso di antibiotici che si rilevano tra differenti Paesi sono giustificate solo in parte da fenomeni epidemiologici e differenze nei modelli di cura.
Si osserva anche che, nei Paesi con alto tasso di prescrizione, la percentuale di medici sulla popolazione è tendenzialmente elevata, mentre quella degli infermieri è ridotta. Altra caratteristica che potrebbe influenzare l’utilizzo di antibiotici e lo sviluppo di resistenze è il numero di letti di terapia intensiva sulla popolazione, che in Italia è circa il doppio di quanto rilevato nei Paesi Bassi e meno della metà del valore della Germania (Rhodes, 2012)[5].
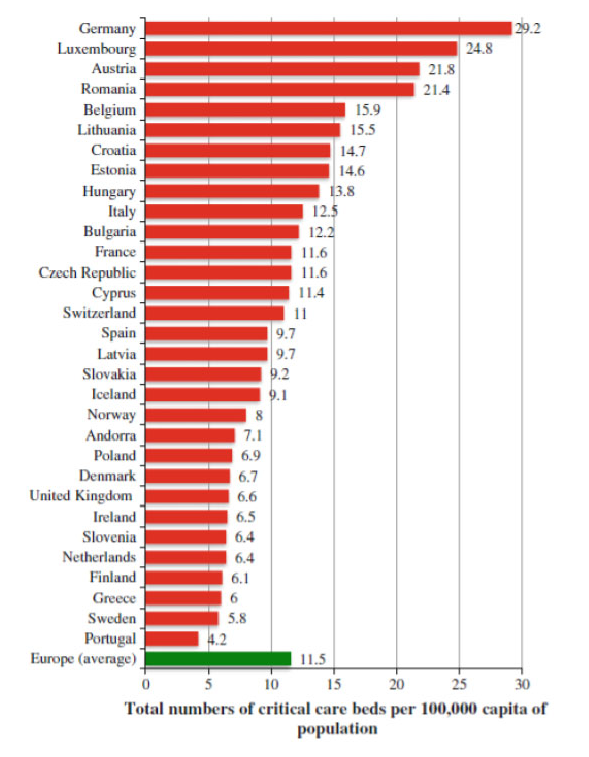
Figura 2 - Numero di letti di area critica per 100.000 abitanti (da Rhodes, 2012 Intensive Care Med)
Ulteriore elemento di valutazione è la struttura della rete di ospedali dell’area geografica in esame, che comporta movimenti di persone e trasferimento di pazienti tra i vari centri.
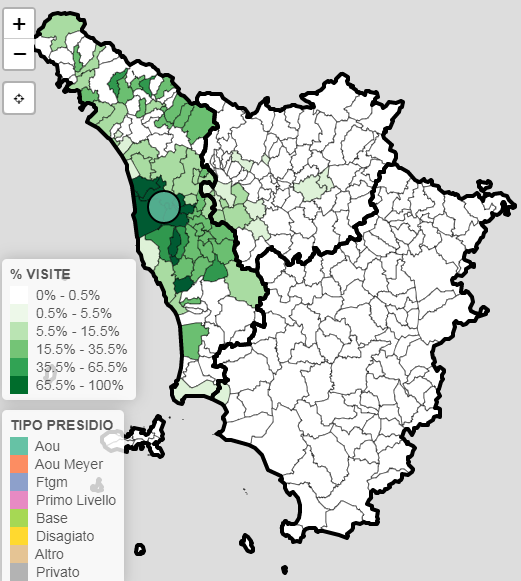
La figura seguente, che rappresenta a titolo esemplificativo la provenienza dei pazienti con ictus assistiti nell’Azienda Ospedaliero Universitaria Pisana, esempio valido per la maggior parte delle condizioni cliniche, mostra come la circolazione dei pazienti in Toscana abbia un’estensione corrispondente all’area vasta. È molto importante disporre di dati di livello regionale e infraregionale, proprio per la possibilità di monitorare accuratamente il fenomeno, potendo fare riferimento alle molteplici caratteristiche in gioco.
Figura 3 - Bacino di utenza del pazienti con ictus assistiti nell’Azienda Ospedaliero Universitaria Pisana (2019, fonte ARS, Flowmap)
Sempre in ottica di aggiungere elementi per una lettura sistemica del fenomeno dell'antibiotico resistenza, è stato chiesto al professor Paolo Bonanni, dell’Università di Firenze, di tenere una lettura magistrale sui meccanismi con cui i vaccini possono contribuire a contrastare l’antibiotico resistenza.
L’argomento era stato già trattato su questa rivista (Grazzini, 2017)[6]. Il Piano di Azione Globale per combattere l’AMR dell’OMS (WHO, 2015) indica come obiettivo strategico quello di aumentare l’investimento nello sviluppo di nuovi medicinali, strumenti diagnostici e vaccini.
I meccanismi con cui i vaccini contribuiscono al contrasto dell’antimicrobico resistenza sono un genuino esempio di interazione complessa (figura 4)[7]
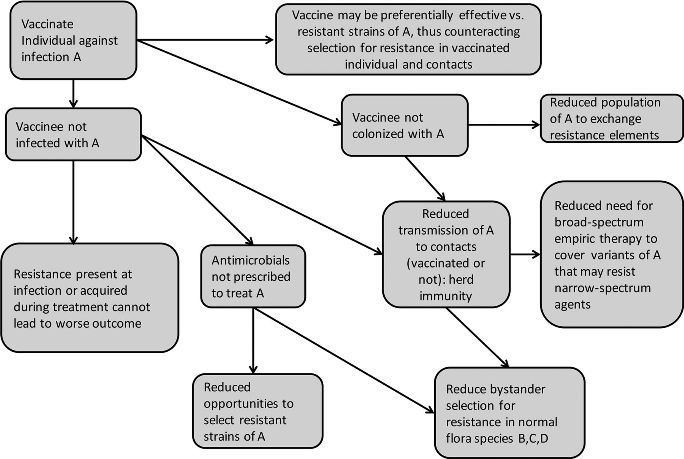
Figura 4 - Meccanismi con cui i vaccini possono contribuire alla riduzione della prevalenza e dell’impatto dell’antimicrobico-resistenza (da Lipsitch, 2016)
Un primo meccanismo è, se vogliamo, ovvio: vaccinare un individuo verso un certo agente comporta un effetto diretto, in quanto se l’individuo non si infetta, una eventuale resistenza presente nel ceppo batterico, o che si può sviluppare durante l’infezione, non ha alcun effetto sull’esito.
Si possono progettare vaccini attivi verso batteri che presentano ceppi antibiotico-resistenti, e conseguentemente evitare la selezione di resistenze nei vaccinati e nei contatti. In ogni caso, vaccinando un soggetto verso un determinato agente batterico:
- si può evitare la colonizzazione da parte dello stesso, riducendo la popolazione microbica in grado di partecipare allo scambio di materiale genetico che determina resistenza
- si riduce la trasmissione del ceppo batterico ai contatti, determinando l’immunità di gregge
- si riduce la necessità di prescrivere terapia antimicrobica empirica ad ampio spettro per coprire i ceppi dell’agente infettivo che possono risultare resistenti a farmaci con spettro ristretto
- si riduce il fenomeno della selezione di microrganismi appartenenti a specie differenti, che sono presenti nella flora batterica normale e che possono acquisire caratteristiche di antimicrobico resistenza a causa dell’utilizzo di antibiotici.
In un articolo di Nature si rappresenta che gli antimicrobici da soli non potranno tenere sotto controllo il fenomeno delle resistenze, e che i vaccini potrebbero svolgere un ruolo chiave in questo ambito: scienziati, politici e i principali stakeholders dovrebbero considerare vaccini e antibiotici come strumenti complementari (Rappuoli, 2017)[8].
Potrebbe addirittura risultare più facile sviluppare nuovi vaccini rispetto a nuovi antibiotici per contrastare l’antimicrobico resistenza. Infatti gli antibiotici devono raggiungere bersagli situati oltre la parete cellulare e evitare di essere espulsi da molecole con funzione di pompa di efflusso: questo comporta grandi difficoltà nello sviluppo di nuovi farmaci. Inoltre gli antibiotici vengono impiegati dopo che una persona è divenuta infetta, e quindi i batteri si sono già replicati nell’organismo e sono presenti in miliardi di cellule: poiché si stima che un batterio su un miliardo può acquisire resistenza attraverso una mutazione spontanea o tramite plasmidi o batteriofagi. Al contrario, con la vaccinazione l‘ospite sviluppa l’immunità prima di incontrare il patogeno e i batteri vengono neutralizzati all'inizio del processo infettivo, quando il loro numero è di poche centinaia o migliaia: le mutazioni in questa fase sono un evento raro.
Poi ci sono altre strategie che vedono coinvolti i vaccini, nel contrasto dell’antimicrobico - resistenza: soprattutto la vaccinazione antinfluenzale riduce il carico di infezioni virali e il potenziale uso inappropriato di antibiotici, oltre che le infezioni batteriche secondarie. Nei vari studi citati dal professor Bonanni nella sua lettura magistrale, si rileva che la vaccinazione antinfluenzale ha ridotto del 64% la prescrizione di antibiotici in pazienti con sindrome influenzale, e che circa la metà degli antibiotici è prescritta inappropriatamente per patogeni com influenza, virus respiratorio sinciziale e altri virus.
L’impatto più evidente dell’effetto delle vaccinazioni su batteri suscettibili a sviluppare resistenza è quello della vaccinazione verso l'Haemophilus influenzae B. Per quanto riguarda lo Streptococcus pneumoniae, sappiamo che la resistenza è legata a espansione clonale di pochi ceppi, con diffusione geografica della caratteristica. La raccomandazione è verso l’utilizzo del vaccino antipneumococcico di maggiore efficacia nei confronti dei ceppi epidemiologicamente più rilevanti, che corrispondono a quelli che manifestano i più elevati tassi di antibiotico - resistenza.
Sono in sviluppo diversi vaccini contro microrganismi portatori di antibiotico resistenza, con grande interesse per i batteri che causano frequentemente infezioni correlate all’assistenza: Enterobacteriaceae, Staphylococcus aureus, Streptococcus agalactiae, Pseudomonas aeruginosa oltre che Clostridioides difficile.
Bibliografia
[1] De Toni AF, Comello L, Ioan L. Auto-organizzazioni. Il mistero dell’emergenza nei sistemi fisici, biologici e sociali. 2011. Marsilio Editori, Venezia
[2] Locey KJ, Lennon JT. Scaling laws predict global microbial diversity. PNAS May 24, 2016 113 (21) 5970-5975.
[3] MacLean RC, San Millan A. The evolution of antibiotic resistance. Science, 2019, 365(6458): 1082-3
[4] Gemmi F. Fattori sociali e culturali nell’uso degli antibiotici. Infezioni Obiettivo Zero, 2019 (29 luglio)
[5] Rhodes A, Ferdinande P, Flaatten H, Guidet B, Metnitz PG, Moreno RP. The variability of critical care bed numbers in Europe. Intensive Care Med (2012) 38:1647–1653 DOI 10.1007/s00134-012-2627-8
[6] Grazzini M. I vaccini come strumento per combattere il fenomeno dell’antibiotico - resistenza. Infezioni Obiettivo Zero, 2017 (aprile)
[7] Lipsitch M, Siber GR. How Can Vaccines Contribute to Solving the Antimicrobial Resistance Problem? mBio, 2016 Jun 7;7(3):e00428-16. doi: 10.1128/mBio.00428-16.
[8] Rappuoli R, Bloom DE, Black S. Deploy vaccines to fight superbugs. Nature, 2017. 552:165-7